Bei einer Hypothyreose werden die von der Schilddrüse produzierten Hormone Thyroxin (T4) und Trijodthyronin (T3) in zu geringem Ausmass hergestellt. Als Folge dieser Mangelversorgung des Körpers mit Schilddrüsenhormon laufen verschiedene Stoffwechselprozesse verlangsamt ab. Körperliche und geistige Leistungsfähigkeit zeigen sich vermindert.
Schilddrüsenerkrankungen gehören zu den häufigsten hormonellen Erkrankungen: Wissenschaftlichen Untersuchungen zufolge leiden 0,5 bis 1,2 Prozent der Bevölkerung an Erkrankungen, die zu einer Hypothyreose führen, und dabei Frauen sehr viel öfter als Männer. Mit zunehmendem Lebensalter steigt die Erkrankungsrate an.
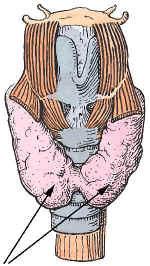
Die Schilddrüse (Pfeile) ist im unteren Teil des Halses, direkt unter dem Schildknorpel lokalisiert.
Wo liegt die Schilddrüse, und welche Funktion hat sie?
Die in der medizinischen Fachsprache auch als Glandula thyroidea bezeichnete Hormondrüse liegt unterhalb des Kehlkopfs direkt vor und an den Seitenflächen der Luftröhre. Die Form der bei Erwachsenen rund zehn Zentimeter breiten Schilddrüse wird gerne mit der eines Schmetterlings verglichen oder als "H-förmig" beschrieben.
Hauptaufgabe der Schilddrüse ist die Produktion der Hormone Thyroxin (T4) und Trijodthyronin (T3). Diese Botenstoffe haben Einfluss auf zahlreiche Stoffwechselprozesse sowie auf Wachstum und Entwicklung. Bestimmte Zellen in der Schilddrüse bilden vor allem das Hormon T4 und lagern es in kleinen Bläschen in der Schilddrüse, den Schilddrüsenfollikeln. Später wird T4 ins Blut abgegeben, wo es ein Depot bildet. Von dort wird das stoffwechselaktive Hormon T3 in verschiedene Gewebe und Organe wie Leber, Niere oder Gehirn abspaltet.
Am besten wird der Bedarf an Schilddrüsenhormonen durch die Bestimmung des Steuerungshormons TSH (Thyreoidea stimulierendes Hormon) widergegeben. Die Hirnanhangdrüse (Hypophyse) reguliert durch das TSH die Ausschüttung der Schilddrüsenhormone ins Blut. Ein Anstieg des TSH-Wertes im Blut ist das erste Zeichen einer Schilddrüsenunterfunktion.
So funktioniert dieser komplizierte Regulationsmechanismus im Detail:
Registriert das Gehirn, dass vermehrt Bedarf an Schilddrüsenhormon besteht, produziert der im Zwischenhirn liegende Hypothalamus den Botenstoff TRH (Thyreotropin Releasing Hormone).
Dieses Hormon gelangt über das Blut in die Hirnanhangsdrüse und regt die Hypophysenzellen zur Bildung und Ausschüttung des Hormons TSH an.
In weiterer Folge gelangt TSH über die Blutbahn zu den Zellen der Schilddrüse, fördert das Wachstum der Schilddrüsenzellen und regt diese Zellen an, T3 und T4 zu produzieren und ins Blut abzugeben.
Ist der vermehrte Bedarf an Schilddrüsenhormon wieder ausgeglichen, wird die weitere Ausschüttung von TSH wieder gedrosselt.
Bei gesunden Menschen hält dieser "thyreotrope Regelkreis" den Blutspiegel von T3 und T4 innerhalb eines bestimmten Normbereichs. Medizinerinnen und Mediziner sprechen dann von einer "euthyreoten Stoffwechsellage", was "regelrechte Schilddrüsenfunktion" bedeutet.
Produziert die Schilddrüse allerdings weniger T4 und T3, als der Körper benötigt, liegt eine Schilddrüsenunterfunktion oder Hypothyreose vor. Eine Ãœberversorgung des Körpers mit T3 und T4 wird als Schilddrüsenüberfunktion oder Hyperthyreose bezeichnet.
Subklinische (latente) und manifeste Hypothyreose
Das von der Hirnanhangdrüse ausgeschüttete Hormon TSH ist der empfindlichste Parameter zur Beurteilung der Schilddrüsenfunktion. Als erstes Zeichen einer Schilddrüsenunterfunktion steigt der TSH-Spiegel im Blut an - man bezeichnet dies als "subklinische" oder "latente" Unterfunktion. Kann die Schilddrüse trotzdem nicht genügend Hormon produzieren, kommt es in der Folge zu einem Abfall des T4 und später auch des T3 - man spricht dann von einer "manifesten Schilddrüsenunterfunktion".
Der obere Grenzwert des TSH wird in den letzten Jahren vermehrt diskutiert. Insbesondere bei Frauen, die eine Schwangerschaft planen, sollte der TSH Wert unter 2.5 µU/ml liegen, da eine ausreichende Versorgung des Körpers mit Schilddrüsenhormon wichtig für den Verlauf einer eventuellen Schwangerschaft ist.
Was sind die Ursachen einer Hypothyreose?
Eine Hypothyreose kann unterschiedliche Erkrankungen als Ursache haben. Grundsätzlich werden die seltenen angeborenen von den wesentlich häufigeren erworbenen Formen der Unterfunktion unterschieden.
Angeborene Unterfunktion der Schilddrüse
Rund eines von 3.000 bis 5.000 Kindern kommt mit einer Schilddrüsenunterfunktion zur Welt. In diesem Fall ist die Schilddrüse beim Baby meist gar nicht oder nur verkümmert angelegt. Seltener sind genetisch bedingte Störungen der Schilddrüsenhormonsynthese die ursächliche Erkrankung, die zur Schilddrüsenunterfunktion führt. Zu den häufigen Anzeichen einer angeborenen Unterfunktion zählen eine verminderte Aktivität des Neugeborenen, eine vergrösserte Zunge, hohes Geburtsgewicht oder Trinkschwäche.
Um Störungen der körperlichen und geistigen Entwicklung zu vermeiden, muss die Unterfunktion bei diesen jungen Patienten umgehend behandelt werden. Deshalb werden in Österreich alle Kinder bereits in den ersten Lebenstagen im Rahmen des sogenannten "Fersenstiches" auf eine mögliche Schilddrüsenunterfunktion getestet. Bei rechtzeitiger Diagnose und sofortigem Behandlungsbeginn ist die geistige und körperliche Entwicklung des Babys meist nicht beeinträchtigt.
Erworbene Unterfunktion der Schilddrüse
Wie die Bezeichnung schon verrät, können verschiedene Erkrankungen im Laufe des Lebens zu einer Schilddrüsenunterfunktion führen. Fast immer handelt es sich dabei um Erkrankungen der Schilddrüse selbst:
Entzündungen der Schilddrüse
Chronische Immunthyreoiditis
Die vom japanischen Arzt Hakaru Hashimoto erstmals beschriebene Autoimmunerkrankung ist der häufigste Grund für eine Hypothyreose. Das Immunsystem erkennt die Schilddrüse "irrtümlicherweise" als fremd und produziert Antikörper gegen das Schilddrüsengewebe: sogenannte TPO-Antikörper (Antikörper gegen Thyreoperoxidase) und Tg-Antikörper (Antikörper gegen Thyreoglobulin). Durch den Gewebszerfall kommt es anfangs zu einer Schilddrüsenüberfunktion. Monate später normalisiert sich die Schilddrüsenfunktion aber wieder und führt längerfristig zu einer Unterfunktion. Die Entzündung ist meist schmerzlos und wird oft erst bemerkt, wenn schon eine Unterfunktion vorliegt. Betroffen sind vor allem Frauen.
Eine Sonderform der chronischen Immunthyreoiditis ist die "Post-Partum-Thyreoiditis", die mehrere Monate nach einer Geburt auftreten kann. Diese heilt oft innerhalb von ein bis zwei Jahren wieder aus.
Andere Schilddrüsenentzündungen
Die subakute "Thyreoiditis de Quervain" ist eine schmerzhafte Viruserkrankung mit grippeähnlichen Beschwerden, bei der es nach einer anfänglichen Phase des Zellzerfalles zu einer Schilddrüsenunterfunktion kommt. Verschiedene andere Entzündungen der Schilddrüse wie zum Beispiel die "Silent Thyroiditis" oder durch Medikamente hervorgerufene Entzündungen können ebenfalls zu einer Schilddrüsenunterfunktion führen.
Medizinische Massnahmen als Ursache
Nicht selten entwickelt sich eine Hypothyreose nach medizinischen Interventionen. So etwa nach einer vollständigen oder teilweisen chirurgischen Entfernung der Schilddrüse, nach einer Radiojodtherapie oder durch zu hohe Dosierungen von Medikamenten, die die Hormonproduktion hemmen (z.B. Thyreostatika). Medizinerinnen und Mediziner sprechen in diesem Fall von einer iatrogenen oder medizinisch induzierten Hypothyreose.
Jodmangel
Lange Zeit war mangelnde Zufuhr von Jod über die Nahrung einer der Hauptgründe für Hypothyreosen, denn Jod ist ein wichtiger Baustein von T3 und T4. In Jodmangelgebieten, wie z.B. der Steiermark, war die Vergrösserung der Schilddrüse aufgrund dieser Unterversorgung in der Bevölkerung so häufig anzutreffen, dass sie sogar sprichwörtlich wurde (Kropf). Seit Speisesalz mit Jod versehen wird, hat mangelnde Jodzufuhr als Ursache für Hypothyreosen hierzulande jedoch an Bedeutung verloren.
Paradoxerweise kann die Zufuhr von höheren Mengen Jod eine Autoimmunerkrankung der Schilddrüse gerade in der Anfangsphase verschlechtern. Bei Vorliegen einer Immunthyreoiditis sollten grössere Mengen Jod, wie sie beispielsweise in manchen Nahrungsergänzungsmitteln enthalten sind, eher gemieden werden.
Störungen der Hirnanhangdrüse
Andere Ursachen für eine Schilddrüsen-Unterfunktion können Störungen der Hypophyse bzw. des Hypothalamus sein. Dabei handelt es sich jedoch um ausgesprochen seltene Krankheitsbilder.
Wie äussert sich die Schilddrüsenunterfunktion?
Bei einer Hypothyreose laufen zahlreiche Organfunktionen und Stoffwechselprozesse, die von Schilddrüsenhormonen beeinflusst werden, verlangsamt ab. Welche der zahlreichen möglichen Beschwerden die Betroffenen entwickeln, ist individuell unterschiedlich und hängt nicht nur von der Ausprägung des Hormonmangels, sondern auch von der genetischen Prädisposition ab.
Zu den möglichen Symptomen einer Hypothyreose gehören:
allgemeines Schwächegefühl, verminderte Leistungsfähigkeit, Antriebslosigkeit und rasche Ermüdbarkeit
Konzentrationsprobleme, Gedächtnisstörungen
depressive Stimmungslage
Herz-Kreislauf-Probleme wie verlangsamte Herzfrequenz (Bradykardie) und niedriger Blutdruck (Hypotonie)
häufiges Frieren, vermehrte Empfindlichkeit gegenüber Kälte, fehlendes Vermögen zu schwitzen
Gewichtszunahme ohne Veränderung der Ernährungsgewohnheiten
Verstopfung durch herabgesetzte Darmtätigkeit
kühle, trockene, raue, schuppige Haut mit gelblichen Verfärbungen
glanzloses, brüchiges Haar mit Haarausfall, auch der Achsel- und Schambehaarung
tiefe, raue, heisere Stimme, langsame Sprache
Schwellung der Augenlider durch Flüssigkeitseinlagerungen (Lidödeme)
erhöhter Cholesterinspiegel im Blut
Zyklusstörungen, Fruchtbarkeitsprobleme, fehlende oder verminderte Lust
Gerade bei älteren Menschen sind uncharakteristische Beschwerden wie verminderte Leistungsfähigkeit, Gedächtnisstörungen und Empfindlichkeit gegenüber Kälte oftmals die einzigen Anzeichen einer Unterfunktion. Weil diese Beschwerden häufig als "Alterserscheinungen" abgetan werden, wird die Altershypothyreose vielfach nicht erkannt.
Wie wird die Schilddrüsenunterfunktion diagnostiziert?
1. Beurteilung der Schilddrüsenfunktion
In erster Instanz geben die Schilderung der Beschwerden und eine anschliessende körperliche Untersuchung erste Hinweise auf eine Unterfunktion der Schilddrüse. Die Schilddrüsenfunktion wird infolge durch eine Blutuntersuchung beurteilt. Wichtigster Parameter ist dabei die Konzentration des TSH. Wenn der Spiegel dieses Botenstoffs im Normbereich liegt, kann eine Hypothyreose praktisch ausgeschlossen werden.
Ist der TSH-Wert hingegen erhöht, spricht dies für das Vorliegen einer Schilddrüsenunterfunktion. Durch die Bestimmung des freien T4 können seltene Störungen der Hypophyse ausgeschlossen werden. In diagnostischen Spezialfällen ist auch der sogenannte TRH-Test hilfreich: Nach Bestimmung des basalen TSH Werts wird die Hypophyse mit TRH stimuliert (Injektion oder Nasenspray), 20-30 Minuten später wird der stimulierte TSH Wert gemessen.
2. Beurteilung der Schilddrüsen-Struktur
Durch eine Ultraschalluntersuchung wird der Aufbau des Schilddrüsengewebes beurteilt. So kann zum Beispiel festgestellt werden, ob die Schilddrüse von Entzündungszellen durchsetzt oder das Schilddrüsengewebe verkümmert ist.
3. Diagnose der zugrundeliegenden Erkrankung
Basierend auf der Beurteilung der Schilddrüsenfunktion und der Schilddrüsenstruktur wird die zugrundeliegende Krankheit diagnostiziert, die einer adäquaten Behandlung zugeführt wird.
Wie wird eine Hypothyreose behandelt?
Die Behandlung der Schilddrüsenunterfunktion hängt von der zugrundeliegenden Erkrankung ab. Bei der weitaus überwiegenden Zahl der Betroffenen ist eine ursächliche Heilung nicht möglich. Diese Patientinnen und Patienten benötigen eine sogenannte Substitutionstherapie, bei der die fehlenden Schilddrüsenhormone in Tablettenform von aussen zugeführt werden. Mittel der Wahl ist dabei meist Levothyroxin (L-Thyroxin, Tetraiodthyronin). Dieses wirkt im Organismus wie das körpereigene T4 und kann das Ungleichgewicht der Schilddrüsenfunktionslage wieder völlig in Ordnung bringen. Nur bei wenigen Betroffenen, bei denen Schwierigkeiten bestehen, T4 im Körper in T3 umzuwandeln, ist eine Kombinationstherapie mit T4 und T3 sinnvoll.
Die Einnahme des Schilddrüsenhormons muss morgens auf nüchternen Magen erfolgen. Anschliessend muss mindestens 30 Minuten gewartet werden, bis gefrühstückt wird. Sonst werden die Tabletten im Verdauungstrakt nur eingeschränkt aufgenommen.
Eine Kontrolle der Schilddrüsenfunktion erfolgt meist zwei bis drei Monate nach Therapiebeginn. Der TSH-Wert hat nämlich erst dann eine verlässliche Aussagekraft, wenn mindestens sechs Wochen lang die gleiche Dosierung eingenommen wird. So lange dauert es, bis sich die Hirnanhangdrüse an die neue Stoffwechsellage anpasst.
Oft muss nach der ersten Blutkontrolle die Dosierung noch weiter angepasst werden. Da sich der Bedarf an Schilddrüsenhormon im Zeitverlauf ändern kann, muss die Dosierung während der Einnahme regelmässig kontrolliert werden. Sind Patienten mit Hypothyreose einmal gut auf das Medikament eingestellt, nehmen sie es regelmässig ein und lassen sie regelmässig Kontrollen durchführen, so steht einem beschwerdefreien Leben nichts entgegen.
Gibt es Nebenwirkungen der Therapie?
Nebenwirkungen treten bei einer Schilddrüsenhormontherapie dann auf, wenn eine zu hohe Dosierung eingenommen wird: Es kommt zu einer "künstlichen" Schilddrüsenüberfunktion. Diese erkennt man an einem verminderten TSH-Wert. Betroffene spüren dann oft auch die Symptome einer Schilddrüsenüberfunktion - Herzrasen, Schwitzen, innere Unruhe oder Durchfall. Nach der Verringerung der Dosis bzw. nach Absetzen des Medikaments in Absprache mit Arzt oder Ärztin verschwinden diese Beschwerden im Normalfall wieder.